Was macht eine Contract Research Organization (CRO)?
Erstellt am: 02.03.2022
Contract Research Organizations (CROs) sind unverzichtbare Partner in der klinischen Forschung. Von der Studienplanung bis zur Datenanalyse - erfahren Sie, wie diese Unternehmen die Entwicklung innovativer Therapien beschleunigen und welche Rolle moderne Technologien dabei spielen.
Was ist eine Contract Research Organization?
Eine Contract Research Organization ist ein Unternehmen, das Dienstleistungen für die pharmazeutische, biotechnologische und akademische Forschung anbietet. CROs unterstützen bei der Durchführung von klinischen Studien, indem sie Fachwissen und Ressourcen bereitstellen, die für die Planung, Durchführung und Auswertung von Forschungsprojekten erforderlich sind. Dies umfasst verschiedene Phasen der klinischen Forschung, von der frühen Phase I bis hin zur Zulassung von Arzneimitteln. Ursprünglich entstanden in den 1970er Jahren als Reaktion auf die zunehmende Komplexität klinischer Studien, haben sich CROs rasch zu unverzichtbaren Partnern für Unternehmen entwickelt, die neue Therapien entwickeln möchten.
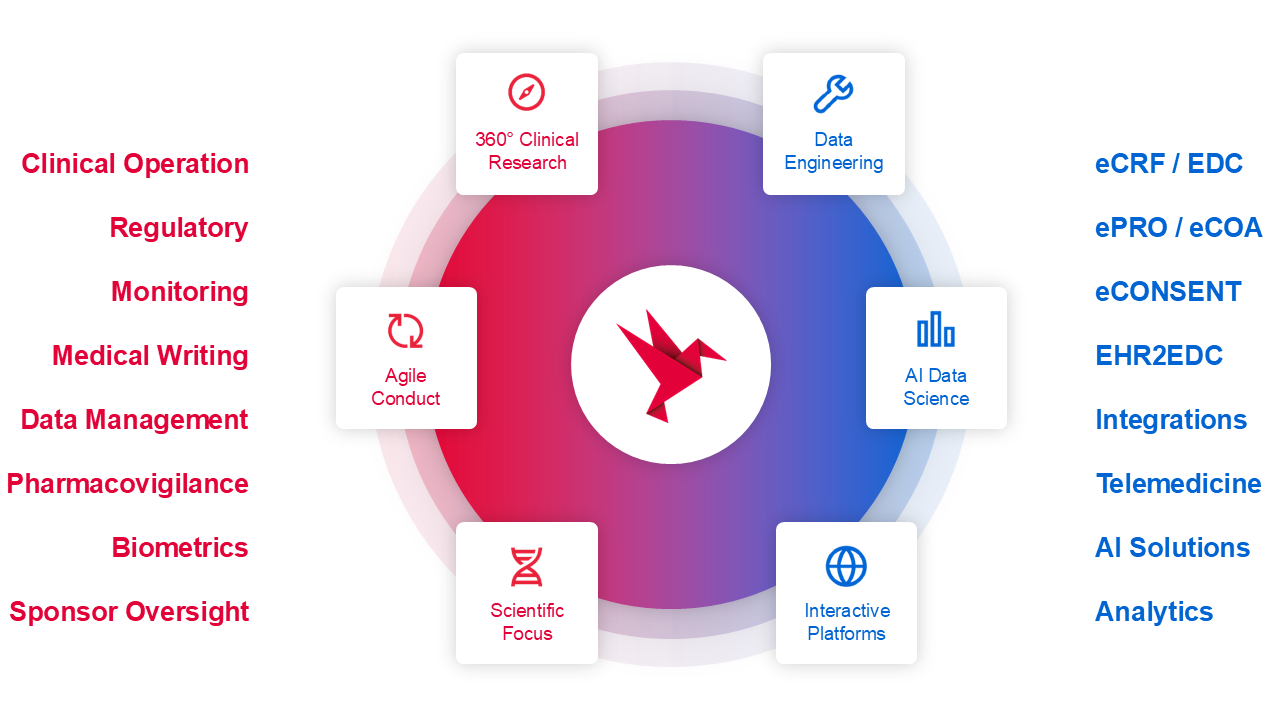
Die Services einer CRO umfassen unter anderem die Entwicklung von Studienprotokollen, die Auswahl geeigneter Studienzentren, die Rekrutierung von Patienten, das Datenmanagement sowie die statistische Auswertung. CROs agieren als Bindeglied zwischen dem Sponsor und den verschiedenen Akteuren einer klinischen Studie, einschließlich Prüfärzten, Ethikkommissionen und Aufsichtsbehörden.
Was macht eine Contract Research Organization?
CROs bieten ein breites Spektrum an Dienstleistungen zur Unterstützung der Planung, Durchführung und Auswertung von klinischen Studien. Diese Dienstleistungen umfassen unter anderem:
-
Studienplanung und -design: Entwicklung von Protokollen und strategischen Plänen für klinische Studien wie der Auswahl geeigneter Standorte.
-
Patientenrekrutierung: Identifikation und Rekrutierung geeigneter Teilnehmer für Studien.
-
Datenmanagement: Erfassung und Analyse großer Datenmengen durch den Einsatz elektronischer Case Report Forms (eCRFs).
-
Regulatorische Unterstützung: Unterstützung bei der Einhaltung gesetzlicher Vorschriften und der Einreichung von Anträgen bei Behörden.
-
Monitoring: Überwachung der Studienabläufe zur Gewährleistung der Qualität und Integrität der Daten sowie der Auswertung der Studiendaten.
Studienplanung und Studiendesign
Ein zentraler Bestandteil der Dienstleistungen einer CRO ist die präzise Planung des Designs klinischer Studien. Die Entwicklung eines robusten Studienprotokolls erfordert tiefgehendes Wissen über therapeutische Ziele, die Zielpopulation und regulatorische Anforderungen. Dazu gehören die Definition von Ein- und Ausschlusskriterien, die Festlegung von Endpunkten und die Auswahl methodischer Ansätze.
Adaptive Studiendesigns ermöglichen Anpassungen während der Studie, um Effizienz zu steigern und die Patientenversorgung zu optimieren. Diese Flexibilität ist besonders wichtig in einem dynamischen regulatorischen Umfeld und minimiert Verzögerungen.
Datenmanagement und Analyse
Contract Research Organizations übernehmen die Erfassung, Speicherung und Analyse der Daten und setzen dabei auf eCRFs, um eine strukturierte und fehlerreduzierte Datenerhebung zu gewährleisten. Digitale Lösungen beschleunigen die Verarbeitung, verbessern die Nachvollziehbarkeit und ermöglichen eine effizientere Zusammenarbeit zwischen Probanden, Studienzentren und Sponsoren. Regelmäßige Qualitätskontrollen und Audits gewährleisten die Datenintegrität und stellen höchste Standards sicher. Zudem ermöglichen moderne Datenmanagementsysteme eine frühzeitige Identifikation von Unstimmigkeiten, wodurch Korrekturen schneller umgesetzt werden können. Ein optimiertes Datenmanagement stärkt nicht nur das Vertrauen in die Studienergebnisse, sondern trägt auch dazu bei, neue Therapien schneller und sicherer auf den Markt zu bringen.
Zulassungsverfahren für klinische Studien
Das Zulassungsverfahren für klinische Studien umfasst umfangreiche Dokumentationen und Nachweise über die Sicherheit der Interventionen. CROs helfen detaillierte Anträge bei zuständigen Behörden einzureichen, die Informationen über das Studienprotokoll, die Methodik, die Auswahl der Probanden und geplante Analysen beinhalten. In Europa spielen die Europäische Arzneimittel-Agentur (EMA) und die jeweils nationalen Gesundheitsbehörden eine zentrale Rolle bei der Genehmigung von Studien. Ein entscheidender Schritt im Zulassungsverfahren ist die ethische Genehmigung, die sicherstellt, dass die Rechte und das Wohl der Probanden gewahrt bleiben.
White Paper
Überwachung und Compliance
Nach der Genehmigung beginnt die Durchführung der Studie, die streng überwacht wird, um die Einhaltung des genehmigten Protokolls und der gesetzlichen Vorgaben sicherzustellen. CROs müssen regelmäßige Audits und Qualitätskontrollen durchführen, um die Integrität der gesammelten Daten zu gewährleisten. Die Einhaltung von Good Clinical Practice (GCP) stellt sicher, dass die Studien ethisch korrekt und wissenschaftlich fundiert durchgeführt werden. Dazu gehören auch Schulungen für das Personal, die sicherstellen, dass alle Mitarbeiter mit den GCP-Richtlinien vertraut sind.
Ergebnisbericht der Studie
Der Abschlussbericht einer Studie, der an die zuständigen Behörden übermittelt wird, muss alle relevanten Informationen zu Verlauf, Ergebnissen sowie eine Bewertung der Sicherheit und Wirksamkeit des Produkts enthalten. Die Qualität dieses Berichts beeinflusst direkt den Zulassungsprozess und die Markteinführung neuer Medikamente.
Die Zukunft von CROs
Die Zukunft der Contract Research Organizations wird maßgeblich durch technologische Innovationen und sich verändernde Marktbedürfnisse geprägt. Die Integration digitaler Lösungen und moderner Technologien wird entscheidend sein, um den steigenden Anforderungen der klinischen Forschung gerecht zu werden.
Ein zentraler Trend ist die personalisierte Medizin, die eine tiefere Analyse von Patientendaten sowie die Nutzung von Real-World Evidence erfordert. Dadurch lassen sich klinische Studien effizienter gestalten und die Versorgung der Patienten gezielter verbessern. Gleichzeitig gewinnen innovative Strategien in der Patientenansprache und -bindung an Bedeutung, um geeignete Teilnehmer schneller und nachhaltiger für Studien zu gewinnen.
Auch der Fokus auf Qualitätssicherung und Compliance wird weiter wachsen. Die Nutzung fortschrittlicher Technologien zur Überwachung von Studien und zur Sicherstellung der Datenintegrität wird unerlässlich sein. Automatisierte Prozesse und KI-gestützte Lösungen werden das Studienmanagement effizienter gestalten und den Zeitrahmen für klinische Studien verkürzen.
Insgesamt bieten technologische Innovationen einer CRO die Möglichkeit, ihre Rolle als strategischer Partner in der klinischen Forschung weiter auszubauen und die Entwicklung neuer Therapien signifikant zu beschleunigen.